AgClは不溶性の塩として知られていますが、アンモニア水には溶解します。この際、下のような反応が起こりジアンミン銀イオンが生成されます。
AgCl+2NH3→[Ag(NH3)2]++Cl–
アンモニア分子のN原子は非共有電子対を持っており、配位結合を形成しやすい分子です。銀イオンに対しても錯体を形成してAgClを溶かしてしまうことができます。
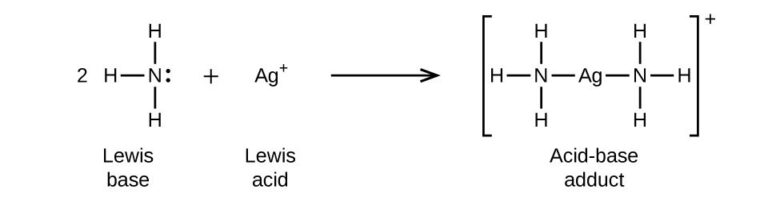

ジアンミン銀イオンは無色透明のイオンだよ。
AgClを溶かすにはチオ硫酸ナトリウムNa2S2O3 を加えて錯イオンを形成する方法もあるよ。
AgCl + 2S2O32- → [Ag(S2O3)2]3- + Cl–