過マンガン酸カリウムの半反応式
過マンガン酸カリウムKMnO4は酸性条件と中性・塩基性条件では反応が異なります。まずは酸性条件から見ていきましょう。
過マンガン酸カリウムは最終的に何になるのかを書く
MnO4– → Mn2+

ここだけは覚えておかなきゃいけないよ。
O原子の数をH2Oで合わせる
MnO4– → Mn2+ + 4H2O
H原子の数をH+で合わせる
MnO4– + 8H+ → Mn2+ + 4H2O
左右の電荷をe–で合わせる
MnO4– + 8H+ + 5e– → Mn2+ + 4H2O

これで完成!
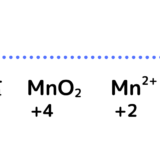
過マンガン酸カリウムは最終的に何になるのかを書く
MnO4– → MnO2

ここだけは覚えておかなきゃいけないよ。
O原子の数をH2Oで合わせる
MnO4– → MnO2 + 2H2O
H原子の数をH+で合わせる
MnO4– + 4H+ → MnO2 + 2H2O
左右の電荷をe–で合わせる
MnO4– + 4H+ + 3e– → MnO2 + 2H2O

これで完成・・・としたいけど、まだです。この反応は中性・塩基性条件なので、4H+は水由来だということがわかります。なので、4OH–を足してあげましょう。原子の数のバランスが崩れるので左右どちらにも加えます。
H+は水由来だとわかるようにする。
MnO4– + 4H+ + 4OH– + 3e– → MnO2 + 2H2O + 4OH–
H+ + OH–はH2Oなのでまとめましょう。
MnO4– + 4H2O + 3e– → MnO2 + 2H2O + 4OH–
左右のH2Oをまとめます。
MnO4– + 2H2O + 3e– → MnO2 + 4OH–

これで完成!