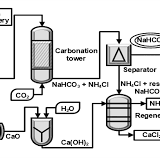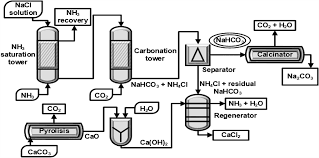
NH3とCO2とH2Oを反応させると、以下の反応が起こるとよく記載されています。
NH3 + CO2 + H2O → NH4+ + HCO3–
しかし実際には一部では反応が進み次の反応も起こっています。
HCO3– + NH3 ⇔ NH4+ + CO32-
しかし、炭酸は弱酸であるためすべてが電離して CO32- となるのではなく、HCO3–とCO32-は平衡状態で存在しています。
HCO3– ⇔ CO32- + H+
ここにNa+と投入すると沈殿しやすいNaHCO3が生じ、HCO3–が消費されていくのでどんどん平衡が左に傾くことになります。

CO32- は存在するけどNaHCO3の沈殿がが生じるほどH+と結合してどんどん HCO3– になっていくんだね。