塩素は酸化力が強くて水と反応する
塩素Cl2もヨウ素I2もハロゲンの単体で無極性分子です。しかし、塩素は水に溶けやすく、ヨウ素は水に溶けづらいという違いがあります。これはなぜしょう。
ハロゲンの酸化力(電子を奪う力)は、F>Cl>Br>Iと周期順です。この酸化力の強さが溶けやすさの理由になります。
酸化力が強い塩素は、水と反応すると自分自身で自己酸化還元反応を起こし、塩化水素HClと次亜塩素酸水HClOへと変化します。つまり、塩素は水と反応するので溶けやすいのです。
Cl2 + H2O → HClO + HCl

この反応は次のような過程で起こります。
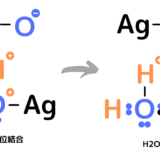
まず、塩素Cl2が水H2Oと出会うと分極を起こし、電子が片方のClに引き寄せられます。正電荷に帯電したClは水H2OのOと配位結合します。

Clが結合したことによって、正電荷を持ったOはHから電子を奪います。その結果、H+が脱離し、HClOが形成されます。H+はCl–と合わさりHClとなります。

酸化数はCl原子のみが変化しているので、この反応を自己酸化還元反応と呼びます。
一方、酸化力がそこまで高くないヨウ素は、水との反応を起こすことができません。そのため、ただの無極性分子なので水に溶けにくいのです。
酸化力が最強のフッ素は自己酸化還元反応などというまどろっこしいことをせずに水から水素を奪います。この反応が起こるため、フッ素は水に溶けます(溶けるというか反応します)。
F2 + H2O → O2 + 2HF

ハロゲン元素であっても酸化力の違いによって水への溶けやすさが変わってくるんだね。