窒素N2
無色で無臭の気体で、空気中の78%を占める。水に溶けにくく、燃焼しない安定した気体である。
窒素の製法
実験室
亜硝酸アンモニウム水溶液を加熱する。
NH4NO2 → N2 + 2H2O
工業的製法
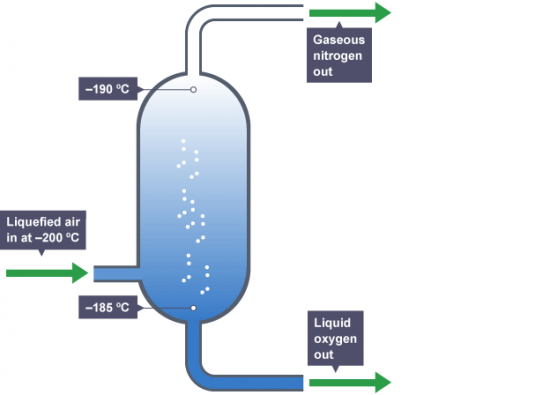
液体空気の分留によって得られる。下画像は沸点が低い窒素(-195.8°C)が気体となって上からでていき、沸点が僅かに高い酸素(-183°C)が液体のまま下から出ていく装置である。
一酸化窒素NO
無色で水に溶けにくい気体である。酸素と反応して二酸化窒素NO2となる。NOは排気ガス等に含まれ、環境問題の原因となっている。
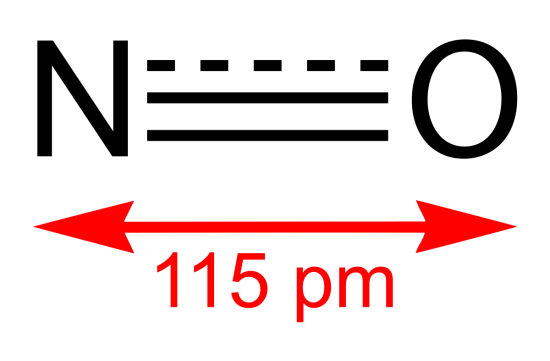
一酸化窒素の製法
銅と希硝酸を反応させる。下動画1:00~が銅と希硝酸の反応。化学反応式は希硝酸は3銅8硝2NO、濃硝酸は1銅4硝2NO2と覚えよう。
3Cu + 8HNO3→3Cu(NO3)2 + 4H2O + 2NO
二酸化窒素NO2
赤褐色で刺激臭の有毒な気体である。常温でN2O4と平衡状態にある。水に溶けると硝酸を生じ、酸性雨の原因となっている。

http://tokushinkan.blog.fc2.com/
二酸化窒素の製法
銅と濃硝酸を反応させる。化学反応式は希硝酸は3銅8硝2NO、濃硝酸は1銅4硝2NO2と覚えよう。
Cu+4HNO3 → Cu(NO3)2+2NO2+2H2O
硝酸HNO3
無色で揮発性がある液体。発煙性があり、特に濃度が高く(98%以上)NO2を多量に含む硝酸は発煙硝酸と呼ばれている。発煙硝酸はNO2の色がついており、赤褐色の液体である。
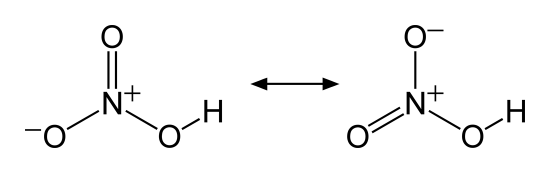
濃硝酸は61%の硝酸水溶液である。希硝酸と以上に酸化作用が強く、Cu、Hg、Agを溶かすことができる。その際にはNO2が発生する。形成された硝酸塩はすべて水に溶ける。

http://jitakuchemistry.blog.jp/
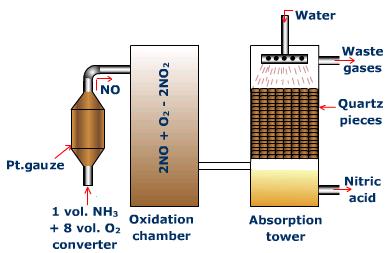
硝酸の製法
オストワルト法で生成する。オストワルト法では、次のプロセスが起こる。
①アンモニアと酸素を反応させて、一酸化窒素を発生させる。
4NH3 + 5O2 → 4NO + 6H2O
②一酸化窒素と酸素を反応させて二酸化窒素とする。
2NO + O2 → 2NO2
③二酸化窒素と水を反応させて、硝酸とする。
3NO2 + H2O → 2HNO3 + NO
これらのプロセスをまとめると、次のような式になる。
NH3 + 2O2 → HNO3 + H2O
http://chem-guide.blogspot.jp/
アンモニアNH3
無色で刺激臭の気体である。水に極めて良く溶けて、水溶液は弱塩基性を示す。HClと反応してNH4Clを生成する(酸塩基反応)。
窒素肥料の硫安(NH4)2SO4(下画像)や尿素CO(NH2)2の原料となっている。

アンモニアの製法
実験室
アンモニウム塩(塩化アンモニウムなど)と強塩基の加熱によって得られる。アンモニアは弱塩基のため、強塩基(Ca(OH)2など)と共に加熱すると、弱塩基遊離反応が起こりNH3が遊離する。
2NH4Cl +Ca(OH)2 → 2NH3 + 2H2O + CaCl2
工業的製法
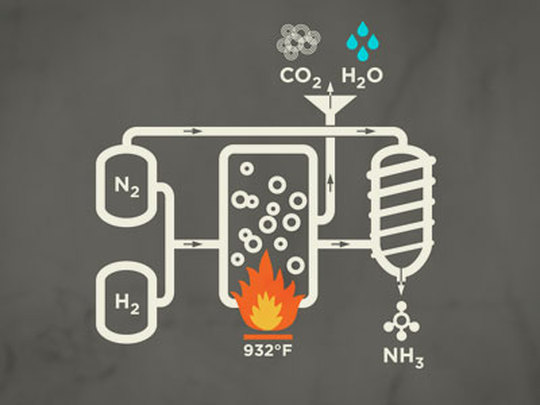
ハーバーボッシュ法によって得られる。ハーバーボッシュ法は、窒素と水素からアンモニアを合成する。普通の状態では窒素と水素が反応するはずもないので、高温・高圧にして、触媒に四酸化三鉄Fe3O4を用いることで反応が進む。
3H2 + N2 → 2NH3