金属イオンの分離
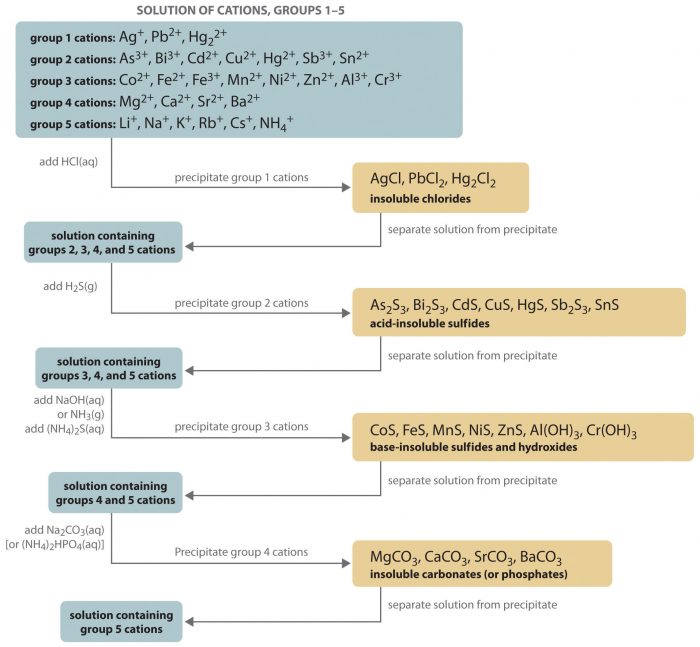
様々な金属イオンが入っている混合水溶液(Ag+、Pb2+、Cu2+、Hg2+、Cd2+、Fe3+、Al3+、Zn2+、Ni2+、Mn2+、Ca2+、Sr2+、Ba2+、Na+、K+…)から、沈殿を生じさせる試薬を用いて、金属イオンを種類ごとに分離することができる。このような分離の方法を系統分離(系統分析)と呼ぶ。
http://2012books.lardbucket.org/
分離させるために用いる試薬を分属試薬と呼ぶ。分属試薬には、希塩酸HCl、硫化水素H2S、アンモニア水NH3、炭酸アンモニウム(NH4)2CO3などがある(必要なイオンさえ含まれてれば良いので必ずしもこれらの薬品でなくとも良い)。試薬を加えて分離させた金属イオンを段階ごとに第1属、第2属・・・・第5属と呼ぶ。
第一属
混合水溶液(Ag+、Pb2+、Cu2+、Hg2+、Cd2+、Fe3+、Al3+、Zn2+、Ni2+、Mn2+、Ca2+、Sr2+、Ba2+、Na+、K+)に希塩酸を加える。するとAgCl白色とPbCl2白色が沈殿する。

沈殿物を熱水に入れると、PbCl2のみ溶解するので、Pb2+を分離することができる。

http://lulelaboratory.blogspot.jp/
第二属
ろ過して沈殿を取り除いたろ液(Cu2+、Hg2+、Cd2+、Fe3+、Al3+、Zn2+、Ni2+、Mn2+、Ca2+、Sr2+、Ba2+、Na+、K+)に、H2Sを通じる。先ほど希塩酸を加えたため、液性は酸性なので、CuS黒色、HgS黒色、CdS黒色が生じる。

第三属
ろ過して沈殿を取り除いたろ液(Fe3+、Al3+、Zn2+、Ni2+、Mn2+、Ca2+、Sr2+、Ba2+、Na+、K+)を加熱してH2Sを除去する。その後、希硝酸を加えて、NH3を加える。すると、Fe(OH)3赤褐色、Al(OH)3白色が生じる。

Fe(OH)3
http://monitoringsrodowiska.bloog.pl/
H2Sを除去するのは、希硝酸と反応してSを生じるためである。
3 H2S + 2 HNO3 → 3 S + 2 NO + 4 H2O
また、希硝酸を加えたのは、H2S(還元剤)によってFe3+がFe2+に還元されていため、元のFe3+に戻すためである。
3Fe2+ + HNO3 + 3H+ → 3Fe3+ + NO + 2H2O
Fe2+のままだと、NH3を加えた時にFe(OH)2が沈殿するが、Fe(OH)2は溶解度が大きく、ろ過によって完全に除去することができない。そのため、溶解度が小さくてろ過で除去できるFe(OH)3を生じさせる必要がある。
第四属
ろ過して沈殿を取り除いたろ液(Zn2+、Ni2+、Mn2+、Ca2+、Sr2+、Ba2+、Na+、K+)にH2Sを通じる。NH3を加えた後のため、液性は塩基性であるから、ZnS白色、NiS黒色、MnS淡赤色を生じる。

第五属
ろ過して沈殿を取り除いたろ液(Ca2+、Sr2+、Ba2+、Na+、K+)に(NH4)2CO3水溶液を加える。すると、CaCO3白色、SrCO3白色、BaCO3白色が生じる。

第六属
ろ過して沈殿を取り除いたろ液(Na+、K+)の炎色反応を確認する。すると、Na+の黄色とK+の赤紫色が確認できる。