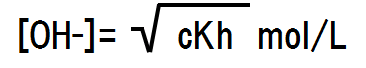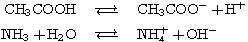塩(えん)の水溶液
塩は酸と塩基の中和反応によって生成されたものである。中和反応を経たのであるから、その塩は中性であると勘違いし易いが、実際はそうではない。強酸・弱酸、強塩基・弱塩基の組み合わせの違いによって液性も変化する。組み合わせとして強い方(強酸or強塩基)の液性が出る。
- 弱酸と強塩基の塩:塩基性
- 強酸と弱塩基の塩:酸性
- 強酸と強塩基の塩:中性
- 弱酸と弱塩基の塩:中性
塩の加水分解
塩の水溶液が必ずしも中性でないのは、塩が水と反応(加水分解)してしまうことによる。
弱酸と強塩基の塩
例えば、酢酸CH3COOHとNaOHの反応では、CH3COONaが生成される。
CH3COONaは、水溶液中ではCH3COO-とNa+に電離している。酢酸は元々弱酸であるため、電離度が低く、イオンの状態でいるよりはH2Oと反応してCH3COOHの状態でいた方が居心地が良い(加水分解)。そのため、水と反応して、一部がCH3COOHに戻る。
その結果、水溶液中にOH-の割合が若干増え、水溶液は塩基性となる。
強酸と弱塩基の塩
上記の反応とは逆に、塩基由来のイオンが水と反応する。その結果、水溶液中にH+が増え、水溶液は酸性になる。
強酸と強塩基の塩
水との反応は起こらない。そのため水溶液は中性となる。
弱酸と弱塩基の塩
酸由来のイオンと、塩基由来のイオンが水と反応する。H+、OH-どちらも増えるため水溶液は中性となる。
加水分解定数Kh
電離した状態の塩と、加水分解された塩は平衡状態にあるため、平衡定数を求めることができる。
この際、水は平衡定数を求める式には含めない。純粋1Lを1000gと考えた場合、水分子量は18のため、1Lは55.5mol/Lとなり、非常に高い濃度となる。希薄な水溶液な場合もほぼ同様の濃度と考えると、加水分解に使用される水分子の増減はほぼ無視できると考えて良い。そのため、加水分解定数Khにおいては、[H2O]は定数として扱い、式には含めない。
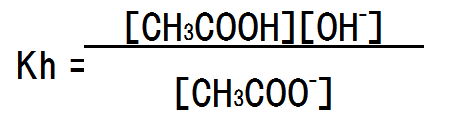
また、上記の式の分母分子に[H+]を掛けると次のようになる。
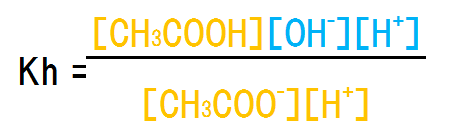
オレンジ色の部分は酸の電離定数Kaの逆数である。また、青色の部分は水のイオン積Kwである。よって、次のように変換できる。
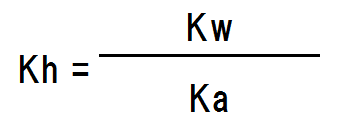
加水分解定数とイオン濃度
加水分解定数Khと平衡前の塩の濃度cからイオン濃度を求めることができる。求める方法は電離平衡の時と変わらない。