とても不安定な原子をベンゼンにぶつけると二重結合が開裂するから
ベンゼン環は本来非常に安定した構造で、ベンゼン環の二重結合が開裂することはあまりありません。しかし、特別な条件下においては付加反応が起こります。
ベンゼンにNi、Pt触媒のもと200℃で高圧の水素を反応させるとシクロヘキサンC6H12が生成されます。
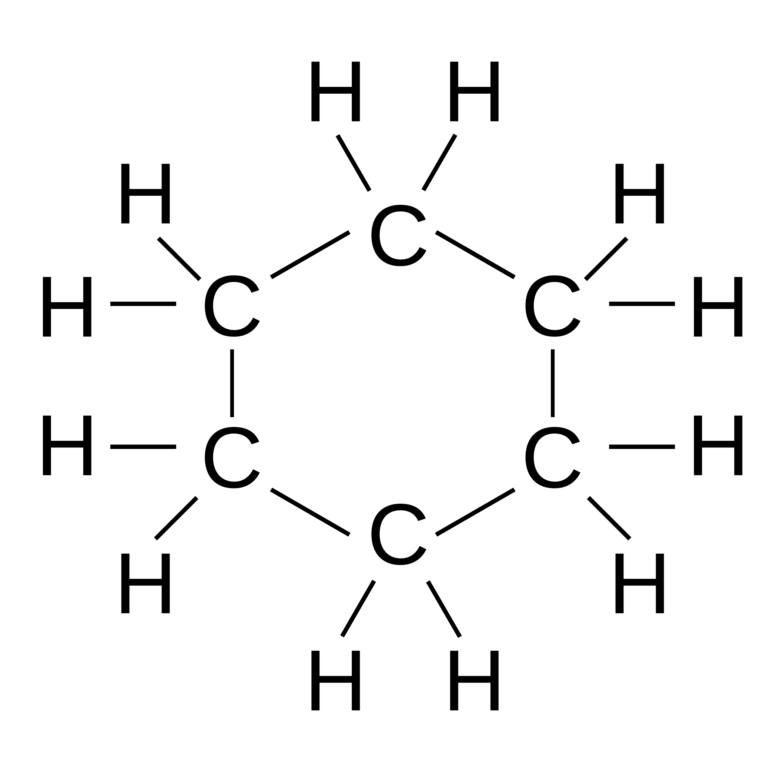
これは触媒の上で吸着されたH・(水素ラジカル)が、ベンゼン環のπ原子を激しく無差別攻撃することによって起こります。水素原子がπ電子と結合すると、ベンゼン環の結合が切断されて安定性が下がり、反応が進みます。その結果、二重結合が全てが開裂してシクロヘキサンになります。
ラジカルとは?
不対電子を残したまま遊離している原子をラジカルと呼びます。不対電子を「・」で表します(例:H・、Cl・)。ラジカルは不対電子をもったまま遊離しているので、非常に反応性が高い状態にあります。
酸素がない状況で光を当てながら塩素を作用させると、ヘキサクロロシクロヘキサンC6H6Cl6が生成されます。下図ではHは省略されています。
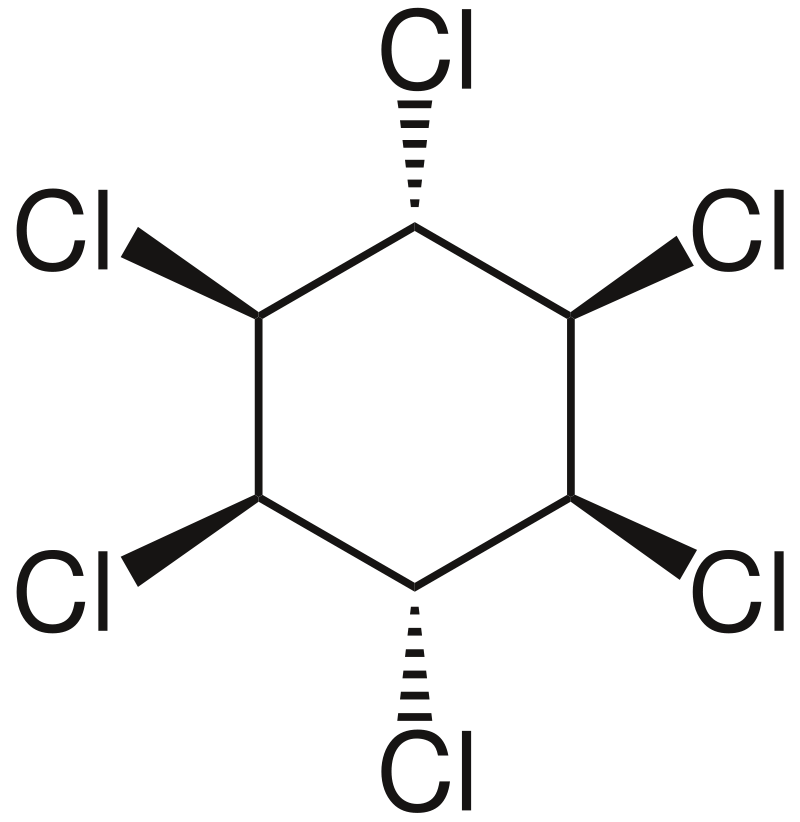
これは、紫外線のエネルギーによってCl2分子が解離してできたCl・(塩素原子)がベンゼン環のπ電子を攻撃することによって起こります。こうして、塩素原子が炭素原子と結合を作っていき、反応が進みます。
ヘキサクロロシクロヘキサンはベンゼンヘキサクロリドとも呼ばれ、殺虫剤として使用されてきましたが、毒性があることがわかったため現在は使用されていません。

ここまでやらないとベンゼン環壊れないって…どれだけ強いんだ…。
ベンゼン環は1.5結合と聞いたことがありますが、どういうことでしょうか。
ラジカルは「過激的な」と直訳されますが、化学産業においては大変重要なものと思いますが、如何でしょうか