Contents
希ガスとは
希ガス(18族)の元素を希ガスと呼ぶ。希ガスであるHe、Ne、Ar、Kr、Xe、Rnは以下のような性質を持つ。

①空気中に少量含まれている。
少量といっても、空気中のArの量はCO2より遥かに多い。

②常温、常圧で無色・無臭の気体である。
下の画像はヘリウムが入った風船。無色である。
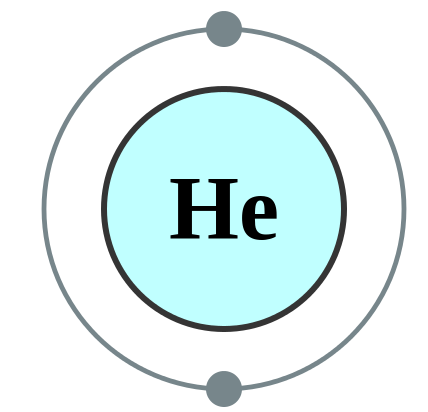
③極めて安定した電子配置をし、単原子分子として存在している。
単原子分子とは、原子1つで存在できる原子を指す。分子と名前が付けられているが、分子は原子2つ以上によって構成されている物質のことなので、厳密に言えば分子ではない。「単原子」と「分子」を分けて考えるのではなく、「単原子分子」として覚えよう。
④ 不燃性である。
安定しているため、白熱電球内に封入されたり、食品袋に封入されることもあった。希ガスの電子配置は安定しており、価電子数は0と見なされている。
⑤低圧下の放電で、特有な発色を示す。
ネオンサインなどに利用されている。これは、例えばNeであれば、放電(電子の衝突)によってNe原子がNe+とe–に分かれ、再びNeに戻るときに放出されるエネルギーが光の正体である。
https://www.boundless.com/
ヘリウム Heの性質
水素の次に軽い気体である。そのため、気球などに利用される。また、沸点が4Kのため、冷却材として用いられる。
アルゴン Ar の性質
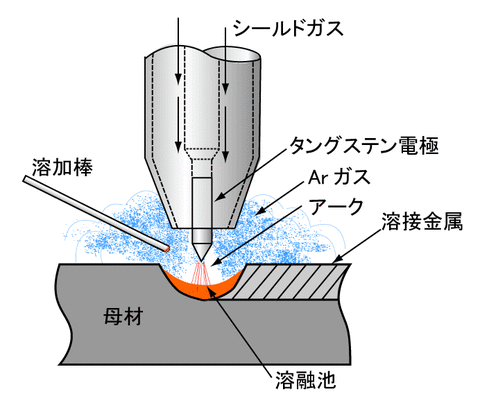
空気中に1%含まれる気体である。蛍光灯や白熱電球に封入される。これは、蛍光管内を真空にするよりも、低圧のガスを封入した方が放電しやすくなるためである。また、金属溶接時の酸化防止としても利用される。
なぜアルゴンの存在比のみが大きいのか
希ガスの大気中の存在比は、He:5.2×10-4%、Ne:1.8×10-3%などであるが、Arは0.93%と非常に大きい。これはなぜであろうか。
大気中のアルゴンの存在比は、他の希ガスと比べて極めて大きい。それは、地殻中に含まれるカリウムの放射性同位体と関係している。放射性同位体カリウムの89%はβ壊変によって、原子核の中性子が陽子と電子に分裂して電子が核外へ放出される。これによってCaが生成される。
一方、残りの11%はβ壊変後に電子を取り込んで、電子と陽子が結合して中性子となり、質量数は同じであるが原子番号が1つ小さいArになる。この反応によって、地殻中でArが生成されるために、他の希ガスよりもアルゴンの存在比は大きいのである。