Contents
水素化合物とは
水素が非金属元素や金属元素と結合した物質を水素化合物と呼ぶ。金属元素との化合物は、金属水素化物と呼ぶ。
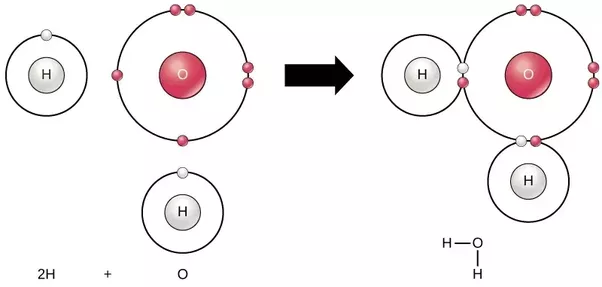
非金属元素との水素化合物
非金属元素との水素化合物は常温・常圧で気体のものが多いが、液体(H2Oなど)のものもある。SiH3(シラン)、PH3(ホスフィン)、NH3(アンモニア)、H2S(硫化水素 下画像)、HCl(塩化水素)などがある。
非金属元素との水素化合物の性質
水素化合物は、結合する非金属の原子番号が増加すると、その性質が規則的に変化する。
| 14族 | 15族 | 16族 | 17族 | |
| SiH4 | PH3 | H2S | HCl | |
| 水溶液の性質 | 中性(溶けない) | 弱塩基性 | 弱酸性 | 強酸性 |
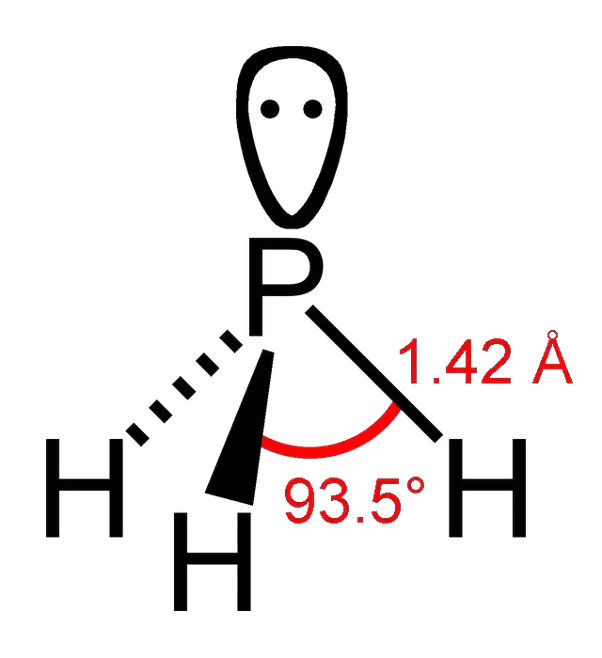
なぜPH3は塩基性なのか
PはNと同じ15族であり、PH3はアンモニア同様に水と反応してOH–を生成する。そのため、その水溶液は塩基性である。
非金属元素との水素化合物の作り方
水素と塩素の混合気体に光を当てると爆発的に反応が進み、塩化水素が生成される。この爆発を塩素爆鳴気と呼ぶ。
350℃の硫黄に水素を通じると硫化水素が生成される。
窒素と水素の混合気体に、触媒を加えて500℃で熱するとアンモニアが生成される。
H–(水素化物イオン)を含む化合物:金属水素化物
水素化リチウムLiH、水素化ナトリウムNaH、水素化カルシウムCaH2などは、水素原子がH–(水素化物イオン)となり、イオン結合し、イオン結晶(金属水素化物)となる。このような性質が水素原子が一族であるのにも関わらず、金属に分類されない由縁である。

金属水素化物の性質
水素化物にはNaH、MgH2、AlH3などがあるが、1族の金属イオンに近いほど強塩基性であり、3族のAlが含まれるAlH3は弱塩基性である。
| 1族 | 2族 | 3族 | |
| NaH | MgH2 | AlH3 | |
| 水溶液の性質 | 強塩基性 | ⇔ | 弱塩基性 |
水素化物は水と反応して、水素を発生し、水素化物となる。NaHは常温の水と激しく反応する。
NaH + H2O → NaOH + H2


Great blog! I really love how it’s easy on my eyes and also the info are well written. I am wondering how I might be notified whenever a new post has been made. I have suebcribsd to your rss feed which ought to do the trick! Have a nice day!