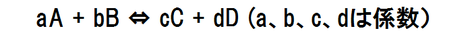化学平衡の法則
下の化学反応のような平衡状態では平衡定数K(Kcとも書く)と圧平衡定数Kpの関係式が成り立つことが知られている。
![]()
平衡定数K
平衡定数Kとは、化学反応の平衡状態を、物質の存在比で表したものである。上記の式aA + bB ⇔ cC + dDが成り立つ場合、平衡定数Kは下の式で求められる。温度一定の平衡状態においてKは常に一定の値を示す。この法則を質量作用の法則と呼ぶ。
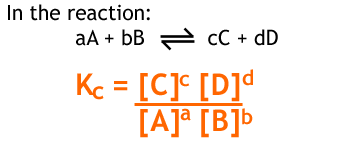
- [ ]は平衡時のそれぞれの物質(A、B、C、D)のモル濃度の値が入る。
- a、b、c、dは化学反応式の係数が入る。
- 発熱反応では高温ほどKの値は小さくなり、吸熱反応では高温ほどKの値は大きくなる。これはルシャトリエの原理と呼ばれる。
質量作用の法則の求め方
ノルウェーのグルベルグとワーゲは、H2 + I2 ⇔ 2HIが平衡状態になったとき、正反応と逆反応の反応速度が等しいことを発見し、平衡定数の式を導きだした。
v1 = k1[H2][I2 ]
v2 = k2[HI]2
平衡状態の時、v1 = v2なので次のようになる。
k1[H2][I2 ]= k2[HI]2
よって、k1/k2の値をKとすると、次の式が成り立つ。

しかし、普通、反応速度式の濃度の次数と、化学反応式の係数は一致しないことが知られている。この反応はたまたま一致しただけであって、平衡定数の式を導き出す正当な根拠とはなり得ない。
こののち、ファントホッフは熱力学から質量作用の法則を導きだされることを証明した。しかし、その内容については、高校化学では扱わない。
ルシャトリエの原理とは
ルシャトリエの原理とは、平衡状態にある反応系において、状態変数(温度、圧力(全圧)、濃度)を変化させると、その変化を相殺する方向へ平衡は移動するという法則である。体積の変化に関しては、「体積の増加」は「圧力の減少」、「体積の減少」は「圧力の増加」と置き換えて理解すると良い。
つまり、反応温度を上げた場合は反応熱を吸収して反応温度を下げる方向へ移動し、 反応温度を下げた場合は反応熱を発生させて反応温度を上げる方向へ移動する。例えば、以下のような発熱反応の場合、温度を上昇させると、反応は左(吸熱反応)へ傾くのである。
H2+I2=2HI+92kJ
ちなみに、圧力の変化に関しては、周囲との熱の出入りが行えないような状態では、反応系の温度が高くなる(もしくは低くなる)。しかし、実際に問題等で問われている状況は、「温度変化させずに圧力を変化させる」という状況であり、十分に周囲と熱の出入りが可能な状況を想定している。圧力を加えたからと言って、温度の増加まで考える必要はない。
例題①
水素4.0molとヨウ素4.0molを10Lの容器に入れて一定温度に保つと、下の式のような化学反応が起こり、平衡状態に達した。平衡状態時にはヨウ化水素が5mol生じていた。この反応の平衡定数を求めよ。
H2 + I2 ⇔ 2HI
ヨウ化水素が5mol生じるためには、H2が2.5mol、I2が2.5mol必要である。よって、平衡時に残っているH2は下のようになる。
4mol – 2.5mol =1.5mol
また、mol濃度は、100L中に1.5molなので下のようになる。
1.5mol ÷ 10L = 0.15mol/L
I2のモル濃度も同様に、(4mol – 2.5mol) ÷ 10L = 0.15mol/L
ヨウ化水素HIのモル濃度は、5.0mol ÷ 10L = 0.50mol/L
これを平衡定数Kを求める式に代入すると、
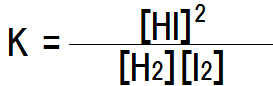
K = (0.5)2÷(0.15×0.15)= 11
例題②
水素1molとヨウ素1molが入った容器10Lが平衡状態に達した時、ヨウ化水素は何mol生じるか。なお、上記問題とは温度が異るため、平衡定数K=25とする。
平衡定数を求める式を利用して、答えを求める。
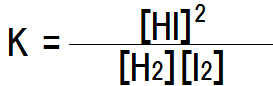
ヨウ化水素をXmolとすると、上の式は次のように展開できる。
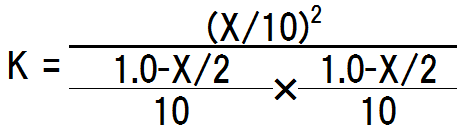
K=25なので、代入すると、
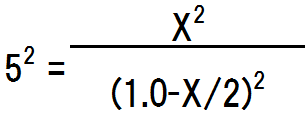
全体が二乗なので、取り外すと、
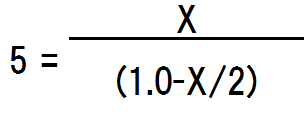
両辺に(1.0-X/2)を掛けて計算すると、
X=1.4
固体が関与する場合の平衡定数
固体はモル濃度が変化せず、平衡に影響を与えないので、平衡定数の計算には含める必要がない。
固体のモル濃度とは、物質量を自身の体積で割ったものである。固体にはびっしりと原子(分子)が詰まっており、反応が進んでも、温度や圧力を加えても、単位体積あたりの物質量は変化しない。そのため、個体のモル濃度は一定値と考える。
例えば、以下のような反応系を考えてみよう。
例: C(固) + CO2(気) ⇔ 2CO2(気)
炭素(固体)の量を、2倍に増やしても、炭素(固体)の濃度は一定のままである(反応容器の体積Vに対してあまり多量に加えないことを前提とする)。そのため、上記の式では、C(固)は式に含めないので、平衡定数は次のようになる。
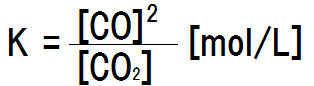
平衡に無関係な物質を加えるとどうなるか
例えば、窒素と水素が反応しアンモニアが生成される反応系に、体積一定でアルゴンArを加えた場合を考えてみたい。
N2 + 3H2 ⇔ 2NH3
アルゴンを加えたとしても、それぞれの物質の物質量が変化するわけではない。つまり、体積一定で物質量の変化がないのであるから、N2、H2、NH3いずれの濃度も変化しない。よって平衡移動は起こらない。
圧力の点から考えても同様である。体積一定で、アルゴンを加えると、加えた分だけ全圧は増えるが、N2、H2、NH3いずれの分圧は変化しない。よって平衡移動は起こらない。
まとめると、体積一定で、平衡に無関係な物質を入れても、平衡移動は起こらないと言える。
もしこれが問題文などで「アルゴンを加えて全圧一定で」と問われるならば、注意が必要である。アルゴンを加えて全圧が一定であるためには、体積が増加しなければならない。つまり、N2、H2、NH3の分圧は減少し、平衡移動が起こる。その移動は、機体の分子数が増加する(圧力減少が緩和される)平衡移動(左向き)である。
触媒を加えた場合の平衡移動
触媒とは、それ自身は変化せずに反応系の活性化エネルギーを減少させるような物質のことを指す。
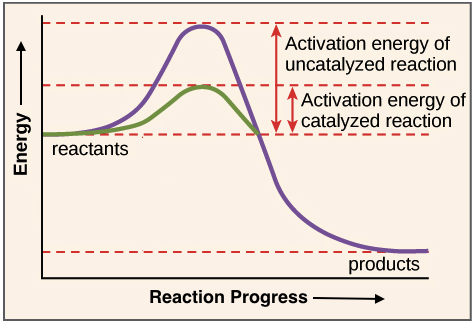
触媒は、正反応と逆反応を同じ割合で増加させるので、平衡定数は変化しない。触媒を加えるということは、「より早く非平衡状態から平衡状態に達する」という意味だと理解しておけば良いだろう。