多段階反応
化学反応は、最終的な生成物にいたるまでにいくつかの過程を経るものがある。そのような反応を多段階反応と呼ぶ。それぞれの反応を素反応を呼ぶ。
律速段階
全体の反応の速度は、最も反応が遅い素反応によって決定する(足手まとい的な)。そのような多段階反応のうちのある段階を律速段階と呼ぶ。
例
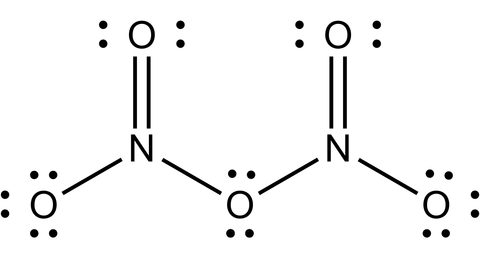
2N2O5 → 4NO2 + O2の反応速度式は、実際に測定すると次の式になる。
v = k[N2O4]
この反応は多段階反応であり、下記段階1の反応が最も遅い素反応なので、律速段階となる。
段階1: N2O5 → N2O3 + O2(遅い素反応) ←律速段階
段階2: N2O3 → NO + NO2(速い素反応)
段階3: N2O5 + NO → 3NO2(速い素反応)