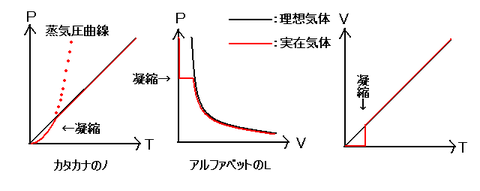
理想気体
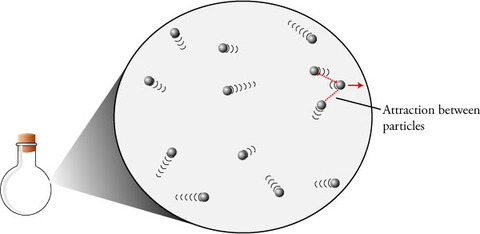
理想気体とは分子間力を想定していなく、分子の体積を0とした仮定した気体である。そのため、①気体を構成する分子の大きさが無視でき、②気体を構成する分子間に働く力が無視できる。このような気体においてのみ、気体の状態方程式は完全に成り立つ。
分子間力等を考慮しない。
実在の気体
理想気体とは異なり、分子間力が働き、分子自身に体積があるため、気体の状態方程式は完全に成り立たない。しかし、高温・低圧の状態では分子間力、分子自身の体積の影響を無視することができ、気体の状態方程式を適応できる。これは、高温にするほど分子運動が激しくなり分子間力を無視することができるようになるためであり、また低圧にするほ分子どうしが離れるので分子間力や分子の体積を無視することができるようになるめである。
理想気体と実在の気体
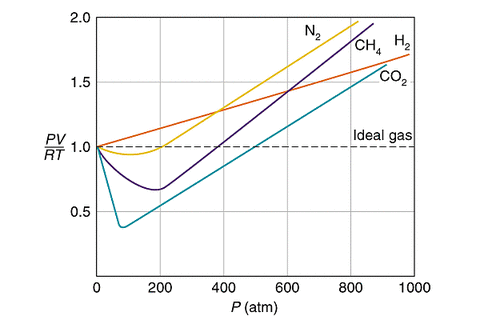
理想気体においては、どんな状態であってもPV=nRTがなりたつので、PV/nRT=1となる。横軸に圧力をとり、縦軸に状態方程式PV/nRT(nは下図では省略されている)を置くと、次のグラフが完成する。Ideal gasとは理想気体のことである。それ以外の実践は実在の気体である。
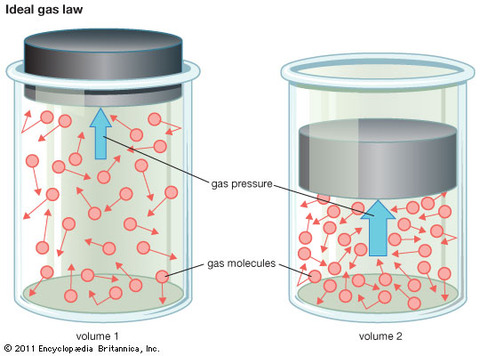
理想気体においては、Pを大きくすればするほど、Vはその分減少するので(P1V1=P2V2)、PV/RTの値は一定となる。
二酸化炭素は、分子量が大きく、分子間力も大きい。そのため圧力を高くすると、やがて液化が起こり、体積Vが急激に減少する(PV/RTが小さくなる)。さらに高圧にすると、Pが大きくなり、PV/RTが徐々に増加する。
水素は分子間力(分子量)が小さいので、圧力を高くしても二酸化炭素のように液化は起こらない。そのため初めからPV/RTが大きくなる