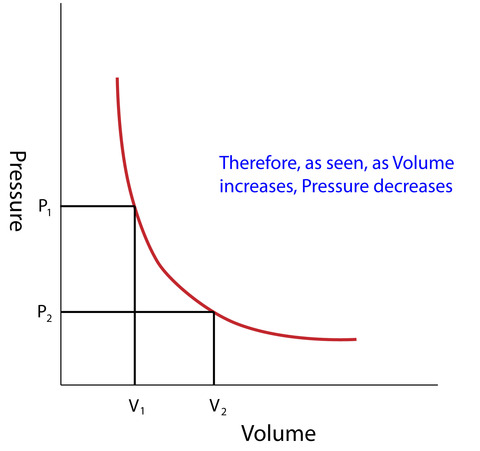
ボイルの法則により、体積(V)は圧力(P)に反比例します。
P1V1 = P2V2
また、シャルルの法則により、体積(V)は絶対温度(T)に比例します。
V1 / T1 = V2 / T2
これらは、物質量(n)が一定の時のみの法則です。ボイル・シャルルの法則によれば、PV / Tは一定になります。
P1V1 / T1 = P2V2 / T2 = 定数
ボイル・シャルルの法則と、アボガドロの「気体1molは、0℃、1atmにおいて22.4Lである」との法則を合わせて、PV / Tの値を求めると次のようになります。
PV / T = 1atm × 22.4L / 273K = 0.0821(atm・L/K・mol)
この0.0821を気体定数(R)と呼びます。Rは8.3J/(K・mol)と変換することもできます。上記の式はあくまで1molの場合であす。2molの場合では2Rに、3molの場合では3Rになります。つまり、次の式となります。
PV / T = nR
このTを左辺に移動したものが、気体の状態方程式である。
PV = nRT
1Jとは1Nの力で物質を1m移動させる仕事に相当します。よって、1J = 1 Nm(ニュートン×メートル)です。またatmとLは次のように変換できます。
1 atm = 1.013 ×105 Pa
1 L = 0.001 m3 …②
Paは1m2あたりにかかる力Nであるから、単位はN/m2に変換できます。よって次のようになる。
1 atm = 1.013 ×105 Pa = 1.013 × 105 N/m2 …①
①と②を0.082 atm・Lに代入すると
0.082 atom・L = 0.082 × 1.013 × 105 ×0.001 (N/m2 × m3)
= 8.3 (Nm)
= 8.3 J
よって、0.082 atm・L = 8.3 Jとなります。
分子量をMとすると、気体w(グラム)の物質量n(mol)は、n(mol) = w(g) / M(g/mol)となる。また、気体の密度d(g/L)は、d = w (g)/ V(L)である。よってPV = nRTに代入すると、次の式が立てられる。
V = w/M ×RT
変形すると…
M=wRT/PV
d=w/Vなので次のようにも変形できる。
M = dRT/P

Which came first, the problem or the sotnoilu? Luckily it doesn’t matter.
Ya learn somhietng new everyday. It’s true I guess!