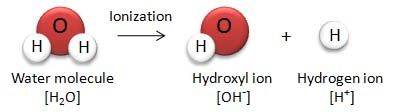
水の電離
水は極わずかにH+とOH-に電離している。
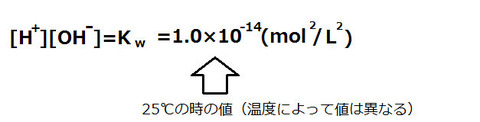
水のイオン積
H+の濃度と、OH-の濃度を掛けたものは1.0×10-14(mol/L)2であり、温度が一定ならばこの値は変化しない。
また、この値はどのような水溶液(酸や塩基)であっても変わらない。H+とOH-は、出会えばすぐに結合してH2Oになる。そのため、中性の溶液に酸が加えられると、H+濃度が高くなり、OH-と出会う頻度が高くなるので、OH-の濃度は低下する。その結果、イオン積は1.0×10-14(mol/L)2に保たれる。塩基を加えてOH-が増えたときも同様の現象が起こる。
なぜ水のイオン積は一定なのか
分かりやすい説明があったので引用。H+とOH-の濃度はH2O全体から見ると、極小数であるということが重要。詳しくは化学の電離平衡で解説。
水の電離について質量作用の法則を適用して平衡定数Kを用いて書くとK=[H+][OH-]/[H2O](Kは温度で決まる定数)であり,常温では水の電離はごくわずかで, 電離による水のモル数の変化は無視できて、[H2O]は一定(水1Lは1Kg=1000gで1000/18(mol/L))と見なせるので、分母を払って[H+][OH-]=K[H2O](=温度で決まる定数)ですから