例えばN2 + 3H2 ⇔ 2NH3に温度・体積一定でアルゴンを加えた場合を考えてみましょう。
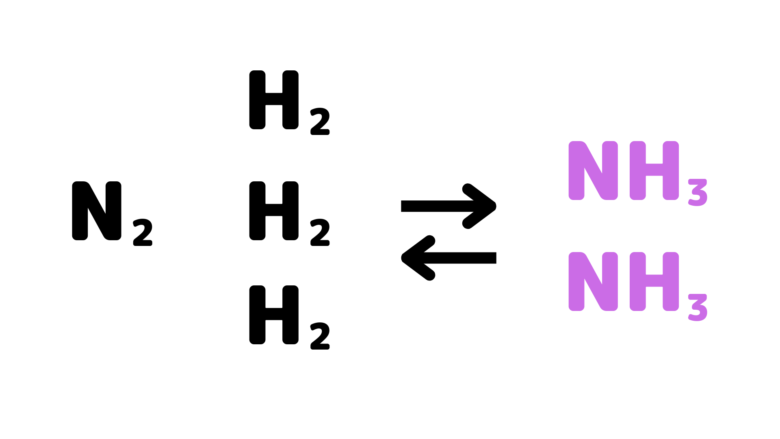
体積一定でアルゴンを加えると、全圧は高くなりますが、それぞれの気体の分圧は変化しません。そのため、平衡移動も起こりません。
N2 + 3H2 ⇔ 2NH3 に温度・全圧一定でアルゴンを加えた場合を考えてみましょう。全圧一定ということは、固定された体積ではアルゴンを入れると圧力が増加するため、アルゴン注入と共に容器の体積が増加することになります。つまり、N2・H2・NH3の気体の分圧は減少します。その結果、圧力減少を緩和する方向(気体の分子数が増加する方向)へ反応が進みます。
N2 + 3H2 ← 2NH3
ちなみに平衡定数は温度に依存する数値なので、温度変化さえしなければ変わりません。

気体の場合にはそれぞれの分圧が変化したら平衡移動が起こるんだね。