Contents
酸化カルシウム CaO
性質
白色固体であり、生石灰とも呼ばれる。塩基性酸化物であり、酸と反応して塩を生成する。
CaO + 2HCl → CaCl2 + H2O
水と反応してCa(OH)2を生成し、発熱する。乾燥剤としてよく用いられる。
CaO + H2O → Ca(OH)2
水酸化カルシウム Ca(OH)2
性質
白色粉末であり、消石灰とも呼ばれる。水溶液は強塩基性であり、飽和水溶液は石灰水と呼ばれる。石灰水にCO2を通じると、白濁(CaCO3)が生成)する。
Ca(OH)2 + CO2 → CaCO3 + H2O
炭酸カルシウム CaCO3
石灰石や大理石の主成分である。強熱すると熱分解し、二酸化炭素とCaOが生成される。
CaCO3 → CaO + CO2
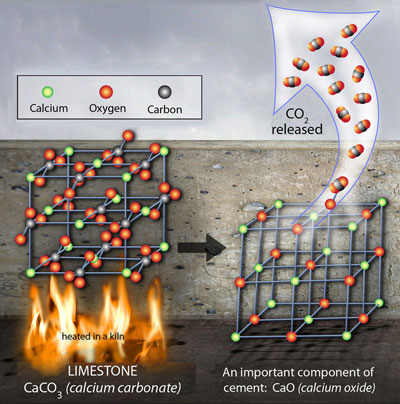
塩酸に溶けるとCO2が発生する。これは弱酸の遊離反応である。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO2を含む水に溶けて、炭酸水素カルシウムを生成する。
CaCO3 + CO2 +H2O → Ca(HCO3)2

セメントやガラスの原料として用いられる。

硫酸カルシウム CaSO4
性質
天然でセッコウCaSO4・2H2Oとして水和物で産出される。140℃で焼くと焼きセッコウに変化する。また、水によって普通のセッコウ(水和物)に戻る。
CaSO4・2H2O ⇔ CaSO4・½ H2O + 3/2 H2O

塩化カルシウム CaCl2
性質
水への溶解性が大きく、吸湿性が大きいため、乾燥剤として用いられる。また、融雪剤、凍結防止剤としても使われる。

http://www.vidar-chemical.com/
次亜塩素酸カルシウム Ca(ClO)2
性質
別名さらし粉と呼ばれる。塩酸と反応して塩素を発生させる。
Ca(ClO)2 + 4HCl → CaCl2 + 2H2O + 2Cl2
製造
Ca(OH)2に塩素を吸収させることによって製造できる。
2Ca(OH)2+2Cl2 → Ca(ClO)2+CaCl2+2H2O


