化合物中のO原子は多くの場合では酸化数-2ですが、例外も存在します。H2O2のOの酸化数は-1です。
そもそも酸化数とは電子の奪われ具合を示しています。電子を1つ奪われていたら+1、逆に電子を1つ得ていたら-1となります。
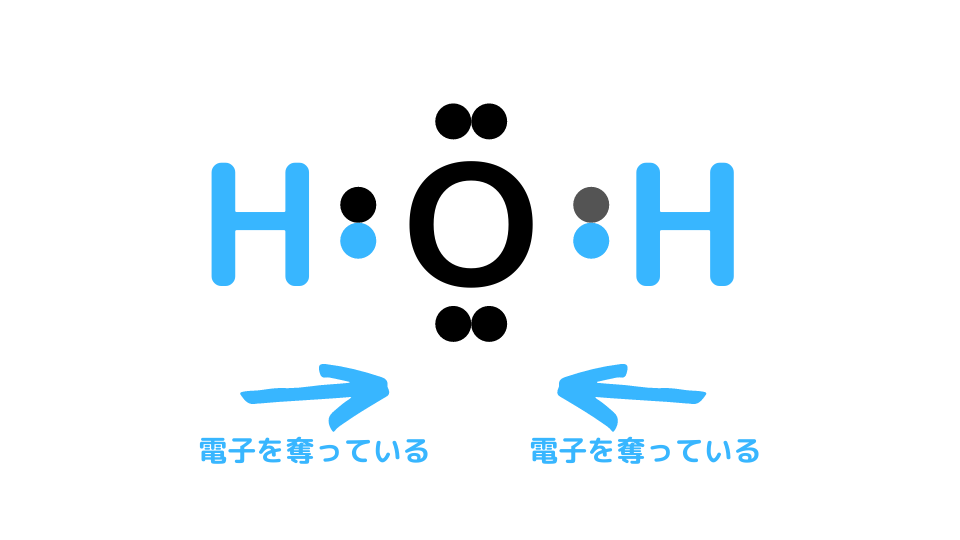
例えばH2Oの場合は、Oが電気陰性度(電子を引き寄せる力)が高いので、H原子から電子を奪っています。この場合はOの酸化数は-2です。
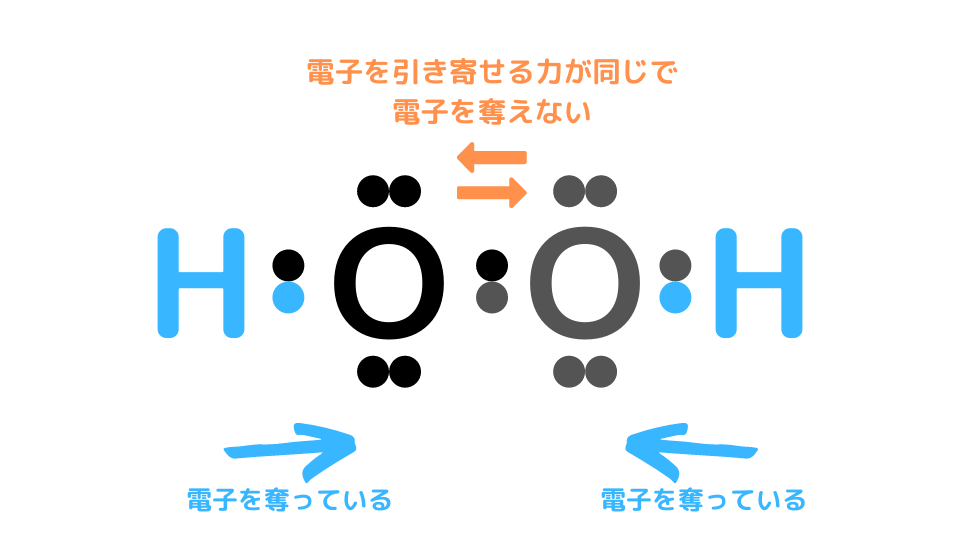
H2O2の場合は、Hからは電子を奪えますが、O同士は電気陰性度が同じなため電子を奪えません。そのため、H1つからしか電子を奪えないので、Oの酸化数は-1になるのです。

Oの酸化数は-2と丸暗記していてはダメで、しっかりと原理を理解しないといけないんだね。