塩の溶解性まとめ
以上のことをまとめると、塩の水への溶解性は次のように整理することができる。

①よく溶ける塩
1族の塩、アンモニウム塩、硝酸塩、酢酸塩は水によく溶ける。
②塩化物
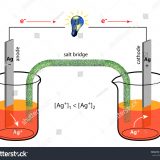
塩化物は水に溶けやすいものが多いが、AgCl、PbCl2、Hg2Cl2(いずれも白色)は水に溶けない。これらの塩化物は次のような性質を持つため、分離することができる。
- AgCl:NH3水に溶ける
- PbCl2:熱湯で溶ける。
- Hg2Cl2:NH3水、熱湯にも溶けない。SnCl2を加えると、Hgの小滴が遊離する。
塩化物で溶けないのは、金属イオンの陽性が小さいためにイオン結合よりも共有結合に近い結合をしており、結合エネルギーが大きくなって電離せずに水に溶けない。
③硫酸塩
硫酸塩は水に溶けやすい物が多いが、CaSO4、SrSO4、BaSO4、PbSO4(いずれも白色)は水に溶けない。Ca、Sr、Baは2族の金属としてまとめると覚えやすい。
④水酸化物
水酸化物は水に溶けにくい。しかし、アルカリ金属、アルカリ土類金属の水酸化物は水に溶ける。
また、両性水酸化物(Al(OH)3、Zn(OH)3、Sn(OH)2、Pb(OH)2)は過剰のNaOH水溶液に溶ける。
また、Ag2O、Cu(OH)2、Zn(OH)2、Ni(OH)2は過剰のNH3水に溶ける。
⑤硫化物
水に溶けにくいものが多いが、1族と2族の硫化物は水に溶ける。これは軽金属の硫化物は純粋なイオン結合を形成できるが、重金属になるほど共有結合性が加わり電離しずらくなるためである。
⑥炭酸塩
水に溶けにくいものが多いが、1族の炭酸塩は水に溶ける。