酸化還元滴定とは
中和滴定はH+の量とOH-の量を等しく反応させ、濃度がわからない溶液の濃度を測定する実験ようそであった。一方、酸化還元滴定とは、 濃度がわからない酸化剤(or還元剤)を、濃度がわかっている還元剤(or酸化剤)と酸化還元反応させ、濃度を測定する実験方法である。
酸化還元反応の終点
中和滴定実験では、指示薬(フェノールフタレインなど)の色が変化した際に完全に反応が終わったと知ることができた。一方、酸化還元反応ではそのような決まった指示薬は無いので、その溶液の性質を利用して終点を調べる。
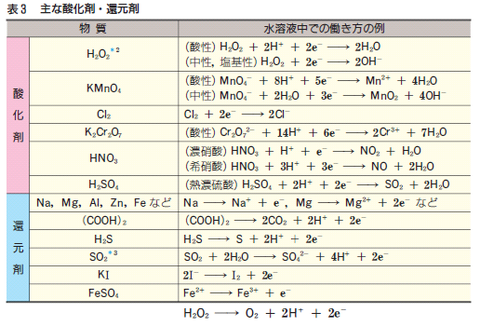
過マンガン酸カリウムを用いた酸化還元滴定
過マンガン酸カリウムKMnO4(過マンガン酸イオンMnO4-)は赤紫色がついている。これが還元されてMn2+になる時に色が消えるため、その時に完全に反応が終わったと知ることができる。
ヨウ素ヨウ化カリウムを用いた酸化還元滴定
ヨウ化カリウムKIは還元剤であり、酸化剤(濃度不明)と反応すると、ヨウ素I2が発生しヨウ素ヨウ化カリウム水溶液となる。この溶液にデンプン水溶液を加えると、ヨウ素I2はデンプンと反応し、紫色に呈色する。さらにこの水溶液にチオ硫酸ナトリウムNa2S2O3などを加えて酸化還元滴定を行うと、紫色が消えた点を終点として実験することができる。
KI + 酸化剤X → 酸化剤Xと反応した分だけI2が発生。
I2 + Na2S2O3 → 紫色が消えた点が終点。I2の濃度が判明し、その結果、酸化剤Xの濃度が判明する。
以下わかりやすい説明引用
①調べたい酸化剤の水溶液適量に過剰のヨウ化カリウムKI溶液を加え、酸化剤を全て反応させてヨウ素を生成させる。※ヨウ素1molを生成させるのに酸化剤が何mol必要か調べておきましょう。②①を濃度既知のNa2S2O3水溶液で滴定する。③ヨウ素の黄褐色が薄くなって淡黄色に近づいたらデンプンを加え、滴定を続ける。なお、水溶液全体が反応するように、滴下するごとに水溶液を振り混ぜる。※初めからデンプンを加えると、デンプンの奥にまでヨウ素が入り込んでしまいます。こうなると酸化還元反応がうまくいきません。デンプンの奥のヨウ素が反応してくれないため、正確な量が測れません。④水溶液中に青紫色の濁りが生じ、水溶液を混ぜても消えなくなったら滴定終了。⑤1molのヨウ素を還元するのに、Na2S2O3が2mol必要。つまり、滴下したNa2S2O3の物質量(mol)の半分が①で生成したヨウ素の物質量(mol)です。このヨウ素を生成させるのに必要な酸化剤の物質量(mol)を求めましょう。ヨウ素やヨウ化カリウムは、直接滴定に使うと反応がうまくいかず正確に滴定できません。(この辺りの仕組は省きます。興味があったら別途調べてみてください。)そのため、このような間接滴定が一般的になっています。わざわざこんな手間をかけてまでヨウ素を使うのは、酸化剤の滴定に利用できる、反応の前後で色が変わるような手頃な還元剤がないからです。もっと使いやすくてかつ正確に滴定できる物質があったらそちらを使うのでしょうが……。
http://detail.chiebukuro.yahoo.co.jp/


Pardon me, Ma’am, but I reckon that down that way, the term “honor killing” isn’t the preferred tegymnolri. “Homicide” or “Capital Murder” is the Politically Correct term. Thankee for your attention, and much obliged.