相対質量と質量数は12C以外一致しない
12C=12.00を除いて、相対質量は質量数(陽子と中性子の数)とは一致しません。これは一体なぜなのでしょう。

確かに言われてみれば不思議。
12Cを基準として陽子と中性子の相対質量も求められていますが、それぞれの値は次のようになっています。
| 陽子の相対質量 | 1.007276470 |
| 中性子の相対質量 | 1.008665012 |

この時点でもうそれぞれ値が1より大きくなっていますが…話を進めましょう。
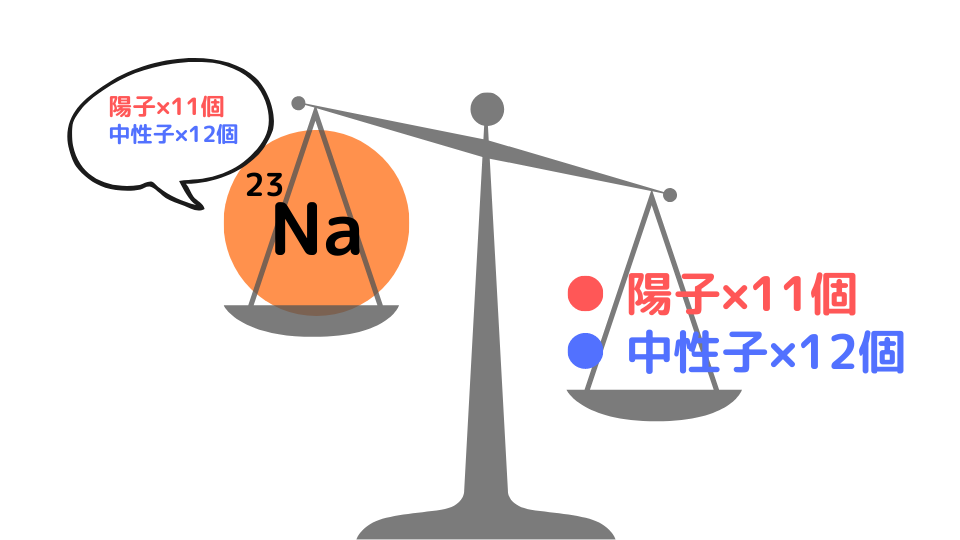
例えば、23Naには陽子が11個、中性子が12個含まれています。先ほどの陽子と中性子の相対質量をもとに、陽子11個と中性子12個の相対質量を足してみると23.18402になります。
1.007276470 × 11個 + 1.008665012 ×12個 = 23.18402
しかし、実際の23Naの相対質量は22.98977になります。つまり、陽子と中性子の相対質量の和よりも軽くなるのです。これを質量欠損と言います。
アインシュタインの相対性理論によると質量とエネルギーは等価なものであり、E=mc2の関係が成り立ちます。つまり、質量が減少したということは、その分が原子核の結合エネルギーに変換されたと考えられます。
相対質量の値と質量数(陽子と中性子の数)が一致しないのは、陽子と中性子の質量が減少して結合エネルギーに変換されてしまうからなのです。

厳密に考えると質量保存の法則は成り立っていないんだね…。

