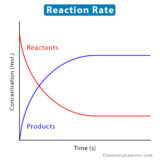
反応速度式でv=k[N2O5]のように、反応物質の濃度に比例するような反応を1次反応と呼びます。一方、v=k [A] 2やv=k[A][B]のような反応を2次反応と呼びます。
1次反応は、1つの原子や分子が他の原子・分子に影響を受けずに自発的に変化していく反応です。そのため、自身の濃度そのものに反応速度が比例します。
一方、2次反応は2分子が衝突することによって進む反応です。例えば、Aの濃度が2倍になれば v=k [A] 2 の反応の場合には衝突回数は 4倍になり、反応速度は4倍になります。一方、 v=k[A][B] の場合は反応速度は2倍になります(Aの濃度が2倍になり衝突回数が2倍になるため)。

反応速度を決定するのは衝突回数なんだね