銅 Cu
赤味を帯びた銅色の金属で、展性・延性に富んでいる。熱・電気を良く通し、電気ケーブル等に利用されている。

イオン化傾向が低く、酸とは反応しない。しかし、酸化剤としての硝酸、熱濃硫酸には溶ける。
銅の合金
合金として青銅(CuとSn)、黄銅(CuとZn 別名真鍮 下画像)が身近に利用されている。

銅の製法
黄銅鉱CuFeS2を酸素で還元し、硫化銅(Ⅰ)Cu2Sとする。

黄銅鉱

硫化銅
さらに還元し、粗銅Cuを得る。粗銅は純度99%の銅を指し、鉄やニッケルなどが僅かに含まれている。

http://big5.made-in-china.com/
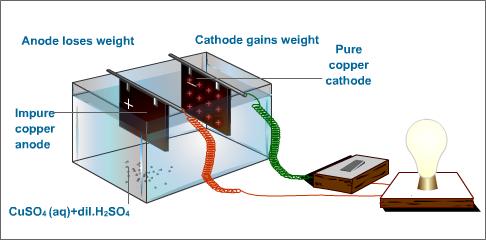
粗銅を陽極、純銅(99.99%)を陰極にして、硫酸銅(Ⅱ)水溶液の中で電気分解を行う。すると、陽極の粗銅がイオン化して溶け出し、陰極では銅イオンが電子を受け取って純銅に付着していく。この過程を電気製錬と呼ぶ。
http://chem-guide.blogspot.jp/

酸化銅(Ⅱ)CuO
黒色の粉末で、塩基性酸化物である。塩基性酸化物なので、酸と中和反応が起こる。

酸化銅の製法
銅Cuを加熱することで酸化銅CuO(Ⅱ)が得られる。
2Cu + O2 → 2CuO
1040℃以上で加熱すると酸化銅(Ⅰ)Cu2Oが得られる。空気中で徐々に酸化されて酸化銅(Ⅱ)になる。Cuは1価のイオンにもなれるが、2価のイオンの方が安定している。

硫酸銅CuSO4
青色が綺麗な結晶として有名である。青色のものは五水和物のみである。

無水塩の利用
燃焼すると、H2Oが抜けて無水塩(水分子が抜けた硫酸銅)になると白色になる。そのため、無水塩は水の検出に利用されている。

.jpg)