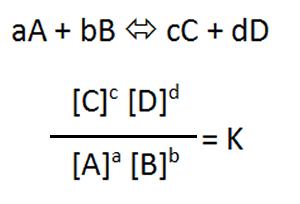反応速度式では、殆どの場合において化学式の係数がそのまま次数となることはありません。化学式の係数が反応速度式の次数として通用するのは、「素反応」と呼ばれる単純に2つの物質がぶつかったりして生じる反応のみです。
例えば、ヨウ化水素の生成反応は次の通りですが…
I2 + H2 ⇔ 2HI
この反応はI2とH2の単純な衝突による素反応(中間反応なし)なので、反応速度式は次のように書けます。
v = k[I2][H2]
しかし、五酸化二窒素の分解反応の化学反応式は次の通りですが…
2N2O5 → 2N2O4 + O2
実際は、下のような中間反応を多く挟み、実際には(i)の分解反応で多くの時間が取られます(最も遅い反応)。
N2O5→N2O3+O2…(i)
N2O3→NO+NO2…(ii)
N2O5+NO→3NO2…(iii)
4NO2→2N2O4…(iv)
そのため、反応速度式は次のようになります。
v = k[N2O5]

この分解反応は、粒子同士の衝突ではなく、壁との衝突によって起こるよ。
平衡定数は、全ての反応をバラバラにし、素反応を求めた上で計算します。実際に五酸化二窒素の反応でやってみましょう。
N2O5→N2O3+O2…(i) ⇒ k1[N2O5] = k1′[N2O3][O2] …①
N2O3→NO+NO2…(ii) ⇒ k2[N2O3] = k2′[NO][NO2] …②
N2O5+NO→3NO2…(iii) ⇒ k3[N2O5] [NO] = k3′[NO2]3 …③
4NO2→2N2O4…(iv) ⇒ k4[NO2]4 = k4′[N2O4]2 …④
⓶と③の左辺右辺同士を掛けます。
k2[N2O3] × k3[N2O5] [NO] = k2′[NO][NO2] × k3′[NO2]3
k2k3[N2O3][N2O5] / k2′k3′ = [NO2]4 …⑤
⑤を④に代入します。
k4k2k3[N2O3][N2O5] / k2′k3′ = k4′[N2O4]2
[N2O3][N2O5] / [N2O4]2 = k2’k3’k4′ / k2k3k4 …⑥
①を⑥に代入します。
k1[N2O5] = k1′[N2O3][O2] これを変形して…
[N2O3] = k1[N2O5] / k1′[O2] これを⑥に代入
…
k1[N2O5] [N2O5] / k1′[O2][N2O4]2 = k2’k3’k4′ / k2k3k4
[N2O5]2/ [O2][N2O4]2 = k1′k2’k3’k4′ / k1k2k3k4
平衡定数の式が完成しました。反応速度式とは違い、係数が次数になりましたね。
[N2O5]2 / [O2][N2O4]2 = k1′k2’k3’k4′ / k1k2k3k4 = K

平衡定数の計算では、複雑な反応でも素反応ごとに分けてしまうから係数=次数になるんだね。