金属のイオン化傾向とは
金属元素とは、電子を放出し、陽イオンになりやすい性質を持つ原子の集団である。しかし、陽イオンのなりやすさも元素によって異なる。つまり、金属元素には還元剤としての強さの順があると言える。還元しやすい順(電子を失い易さ順)に金属元素を並べたものを金属のイオン化傾向と呼ぶ。
覚え方は、次のように覚えたら良いだろう。
リッチ(Li)に貸(K)そうか(Ca)な(Na)ま(Mg)ぁ(Al)あ(Zn)て(Fe)に(Ni)すん(Sn)な(Pb)ひど(H2) す(Hg) ぎ(Ag) るしゃっ(Pt) きん(Au)
リッチに貸そうかな。まぁあてにすんな、ひどすぎる借金。
金属の析出
金属のイオン化傾向が高ければ高いほど、電子を放出して陽イオンになる性質が強く。イオン化傾向が低ければ低いほど、電子を受け取って原子の状態になる性質が強い。この性質を利用して水溶液中にイオンとして溶けている金属を析出させることができる。
Cu2+ + Fe → Cu + Fe2+
Ag++ Fe → Ag + Fe2+
動画は銀と鉄の反応ではない。
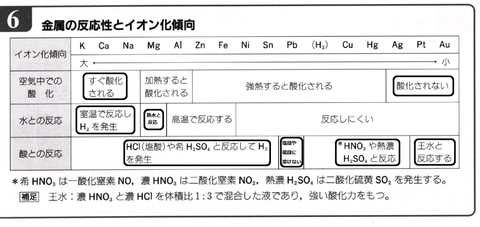
酸素、水、酸との反応
残念ながら、下の表は覚えなければならない。イオン化傾向によって、酸素・水・酸との反応の仕方が異なる。
常温での水との反応
反応後はアルカリ性になる。
Ca + 2H2O → Ca(OH)2 + H2
熱水との反応
こちらも同様にアルカリ性になる。
Mg + 2H2O → Mg(OH)2 + H2
塩酸などの酸との反応
金属が酸と反応するのは、H2のイオン化傾向より高いためである。H2よりもイオン化傾向の低い金属は、酸化剤として高い酸化力を持っている酸としか反応しない。
Zn + 2HCl → ZnCl2 + H2
硝酸など酸化力の強い酸との反応
酸化剤としての酸と金属の反応。
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
必ずしも反応しない金属
Al、Fe、Niは、濃硝酸などに浸すとたちまちにして表面に酸化皮膜を形成し、それ以上反応しなくなる。このような状態を不動態と呼ぶ。
Pbも同様に、塩酸や希硫酸に浸すと難溶性のPbCl2、PbSO4などが生じ、それ以上反応しなくなる。