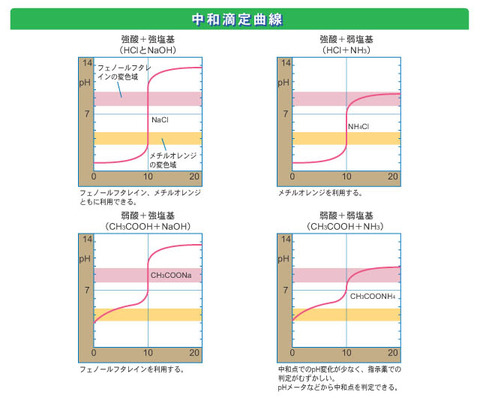
中和滴定曲線とは
中和滴定した際のpHの変化をグラフ化したものを中和滴定曲線と呼ぶ。 縦軸がpHであり、横軸は滴下量(ml)である。
なぜ急激にpHが変化するのか(pHジャンプ)
縦軸pHが対数であるのに対し、横軸は普通の数字(滴下量ml)であることに由来する。
表にして見てみると
pH1の時、H+の濃度は、0.1mol/l
pH2の時、H+の濃度は、0.01mol/l
pH3の時、H+の濃度は、0.001mol/l
pH4の時、H+の濃度は、0.0001mol/l
pH5の時、H+の濃度は、0.00001mol/l
pH6の時、H+の濃度は、0.000001mol/l
pH7の時、H+の濃度は、0.0000001mol/l
pH8の時、H+の濃度は、0.00000001mol/l
…
と、pHは1ずつ減少すると、H+の濃度は1/10ずつ減少していく。
pH1からpH2へは、0.9mol/lの減少であるが、pH7からpH8へは僅か0.00000009mol/lの減少であれば良い。そのため、NaOHを一滴滴下しただけで、急激にpHが上昇してしまうという現象が起こる。
中和点での液性
中和滴定曲線において、酸の出すH+と塩基の出すOH-の量が同じになった点を中和点と呼ぶ。 中和によって生成された塩が加水分解するため、酸と塩基の種類によって必ずしも中性ではない。
- 強酸と強塩基の中和点:中性 どの指示薬でも良い
- 弱酸と強塩基の中和点:塩基性 指示薬にはフェノールフタレインを使用する。
- 強酸と弱塩基の中和点:酸性 指示薬にはメチルレッドを使用する。

それなら指数関数的なグラフになっているはずで、PHジャンプの説明になっていないと思う。