Contents
半反応式とは
その物質がどのように酸化還元反応するか(電子がどのように移動するか)を示した式を半反応式と呼ぶ。式の中に電子e-が含まれていることが特徴である。半反応式の書き方がわかれば、反応物と生成物を知っているだけで電子の授与の式を求めることができる。
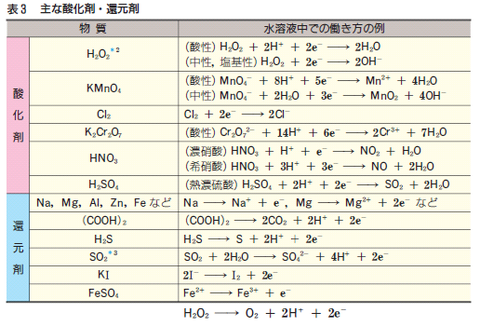
半反応式の作り方 -過酸化マンガンイオン(酸化剤)の場合-
①左辺に反応前の物質、右辺に反応後の物質を記す
MnO4– → Mn2+
②酸化数の変化を調べて、両辺の差が無くなるように電子e-を書く
- 左辺は、O4の酸化数=-2×4=-8であり、全体が-1になるようにと考えると、Mnの酸化数は+7となる。
- 右辺は、Mn2+の酸化数は、イオンの価数そのままとなるので+2である。
- 左辺+7、右辺+2なので、差が無くなるように左辺にe-を5つ加える。
MnO4– + 5e– → Mn2+
③両辺の電荷が同じになるようにH+を記す
左辺の電荷は-6、右辺の電荷は+2なので、左右同じになるように左辺にH+を8つ加える。
MnO4– + 8H+ + 5e– → Mn2+
④両辺の水素Hの数が同じになるようにH2Oを記す
左辺にH+が8つあるのでH2Oを右辺に4つ加える。
MnO4– + 8H+ + 5e– → Mn2+ + 4H2O
半反応式の作り方 -二酸化硫黄(還元剤)の場合-
①左辺に反応前の物質、右辺に反応後の物質を記す
SO2 → SO42-
②酸化数の変化を調べて、両辺の差が無くなるように電子e-を書く
- 左辺は、O2の酸化数は-4であるため、Sの酸化数は+4である。
- 右辺は、O4の酸化数は-8であり、全体が-2になるようと考えると、Sの酸化数は+6となる。
- 左辺+4、右辺+6なので、差がなくなるように右辺にe-を2つ加える。
SO2 → SO42- + 2e–
③両辺の電荷が同じになるようにH+を記す
左辺の電荷は0、右辺の電荷は-4なので、左右同じになるように右辺にH+を4つ加える。
SO2 → SO42- + 4H+ + 2e–
④両辺の水素Hの数が同じになるようにH2Oを記す
右辺にH+が4つあるのでH2Oを左辺に2つ加える。
SO2 + 2H2O → SO42- + 4H+ + 2e–


この記事の前の 3、酸化剤と還元剤 の記事が 削除されています という表示で 閲覧できません。記事をupして頂けると 嬉しいです。